Estudio
Los efectos del CYA en el equilibrio del agua y el yeso
El efecto del ácido cianúrico en el equilibrio del agua y el yeso
Cuando se mide la alcalinidad total en una piscina, se está midiendo la alcalinidad tanto del carbonato como del cianurato en el agua. El ácido cianúrico ayuda a amortiguar el pH en el agua de la piscina, pero no protege el yeso. Se necesita alcalinidad de carbonato para proteger el yeso. Por lo tanto, cuando se calcula el Índice de Saturación de Langelier (ISL), solo debe utilizarse la alcalinidad de carbonato para determinar si el agua es incrustante o corrosiva. Se debe utilizar la siguiente ecuación para calcular la alcalinidad de carbonato:
Alcalinidad de carbonato = alcalinidad total – (concentración de ácido cianúrico/3)
Por ejemplo, si la alcalinidad total es de 80 ppm y la concentración de ácido cianúrico es de 100 ppm,
Alcalinidad de carbonato = 80 – (100/3)
= 80 – 33
= 47 ppm
La importancia de realizar esta corrección queda clara en este ejemplo, donde un valor de 80 ppm podría llevar a pensar que el agua no era corrosiva, pero con una alcalinidad de carbonato de 47 ppm, el agua está claramente en el lado corrosivo.
Se realizaron pruebas en piscinas con muestras de yeso con niveles de ácido cianúrico de 0, 25-50, 110-125 y 200-250 ppm. Los parámetros del agua se mantuvieron a un pH de 7,2 a 7,6, alcalinidad de carbonato de 80-120 ppm, dureza cálcica de 180-250 y cloro disponible de 1-4 ppm. Después de 12 meses de funcionamiento, las imágenes a continuación muestran la degradación superficial en las muestras de yeso en todas las piscinas. Las piscinas mantenidas sin estabilizador de ácido cianúrico mostraron el menor daño superficial.
A pesar de las condiciones equilibradas del agua de la piscina en las pruebas, aún se observó degradación del yeso. Estos resultados indican que la presencia de ácido cianúrico en el agua corroe las superficies de yeso, y que se debe usar una cantidad mínima solo si es necesaria la estabilización del cloro.

Equilibrio del agua
El pH es el logaritmo negativo de la concentración de iones de hidrógeno. La siguiente ecuación expresa la relación entre los iones de hidrógeno (H+) y el pH:
pH = -log[H+]
donde [H+] es la concentración de iones de hidrógeno.
El signo negativo en la ecuación significa que si el nivel de iones de hidrógeno aumenta, el pH disminuye. Por el contrario, si el nivel de iones de hidrógeno disminuye, el pH aumenta.
El “log” significa que cambios drásticos en [H+] solo producirán pequeños cambios en el pH. A la inversa, pequeños cambios en el pH pueden significar cambios drásticos en [H+]. A continuación se muestra una breve tabla con algunos valores logarítmicos:
Esto significa que si el pH disminuye en 1 unidad, entonces la concentración de H+ ha aumentado 10 veces.
Los productos químicos que aportan iones de hidrógeno al agua se denominan ácidos y disminuyen el pH. Un ejemplo es el ácido muriático (HCl), también llamado ácido clorhídrico. Cuando se añade HCl al agua, ocurre lo siguiente:
De esta ecuación, queda claro que el ácido muriático está aportando iones de hidrógeno al agua y, por lo tanto, añadir ácido muriático a una piscina reducirá el pH.
Para estabilizar las concentraciones de H+ en el agua de la piscina y, por ende, estabilizar el pH, utilizamos tampones. Los tampones son sustancias químicas que pueden absorber o aportar H+ según sea necesario.
El tampón más común utilizado en piscinas es el carbonato. El carbonato puede estar presente en el agua como ácido carbónico (H2CO3), bicarbonato (HCO3-) o carbonato (CO32-). El siguiente gráfico muestra cuánto de cada especie está presente con diferentes valores de pH. El rango de pH para piscinas (7,2 – 7,8) está resaltado en amarillo.
En los valores de pH de las piscinas, la mayoría del carbonato está presente como bicarbonato con algo de ácido carbónico. Si se añade un ácido a la piscina, el bicarbonato en el agua puede absorber los iones de hidrógeno y formar ácido carbónico:
HCO3- + H+ →H2CO3
Por lo tanto, el pH no disminuiría significativamente hasta que se haya agotado la mayor parte del bicarbonato en el agua.
De manera similar, si se agrega algo con un pH elevado al agua de la piscina que elimina iones de hidrógeno, el ácido carbónico puede ceder un ion de hidrógeno para reemplazar el que se perdió:
H2CO3 → HCO3- + H+
Por lo tanto, el pH no aumentaría significativamente hasta que se haya agotado la mayor parte del ácido carbónico en el agua.
El ácido cianúrico también es un amortiguador en el agua de la piscina. La siguiente estructura muestra que tiene la capacidad de unir y liberar tres iones de hidrógeno:
Cuando los tres átomos de hidrógeno están unidos al anillo, se denomina ácido cianúrico. El término general “cianurato” se utiliza para el anillo con 1, 2 o los 3 átomos de hidrógeno faltantes. El siguiente gráfico muestra cuánto de cada especie está presente con pH variable.
El ácido cianúrico es eficaz para amortiguar el pH, pero no es adecuado para proteger el yeso. De hecho, existen evidencias de que puede dañar el yeso. Este tema se discute a continuación. Por lo tanto, al mantener el equilibrio del agua en una piscina o spa, es importante mantener la concentración adecuada de alcalinidad de carbonato. El rango recomendado por la Asociación de Profesionales de Piscinas y Spas (APSP) y el Código Modelo de Salud Acuática (MAHC) es de 60-180 ppm.
Cuando se realiza una prueba de alcalinidad total, se miden todos los amortiguadores en el agua, incluidos tanto el carbonato como el cianurato. Para convertir una lectura de alcalinidad total a alcalinidad de carbonato, se debe utilizar un factor de conversión de ácido cianúrico. El factor es aproximadamente 1/3, pero varía con el pH.
La siguiente ecuación general puede utilizarse para calcular la alcalinidad de carbonato:
Alcalinidad de carbonato = alcalinidad total – (concentración de ácido cianúrico/3)
Por ejemplo, si la alcalinidad total es de 80 ppm y la concentración de ácido cianúrico es de 100 ppm,
Alcalinidad de carbonato = 80 – (100/3)
= 80 – 33
= 47 ppmLa importancia de realizar esta corrección es evidente en este ejemplo, donde un valor de 80 ppm podría llevar a pensar que el agua no es corrosiva, pero con una alcalinidad de carbonato de 47 ppm, el agua es claramente corrosiva.
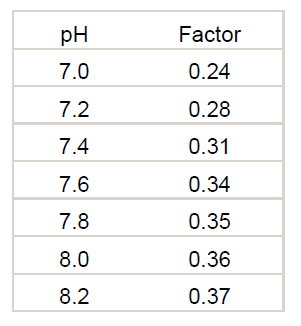
El valor del factor de corrección del ácido cianúrico varía con el pH. Si se necesita un número más exacto, se debe utilizar la siguiente tabla.
Donde alcalinidad de carbonato = alcalinidad total – (concentración de ácido cianúrico x Factor)
El Índice de Saturación de Langelier (LSI) se utiliza a menudo para predecir si el agua en una piscina será corrosiva o incrustante. Los factores que intervienen en el cálculo del LSI son pH, alcalinidad
de carbonato, dureza cálcica, sólidos disueltos totales (TDS) y temperatura. A continuación se presentan los factores de APSP-11.
Estos factores se utilizan en la siguiente ecuación: LSI = pH + TF + AF + CF – Factor TDS
El rango recomendado según APSP-11 es de -0,3 a +0,5. Los valores inferiores a -0,3 indican que el agua será corrosiva. Los valores superiores a +0,5 indican que el agua será incrustante. Es importante que se utilice la alcalinidad de carbonato en el cálculo del LSI, no la alcalinidad total.
Yeso
La química del yeso es muy compleja, pero los componentes principales del yeso son el cemento Portland y los agregados. El agregado es el polvo de mármol, arena o guijarros utilizados en el yeso. El cemento Portland se emplea para cementar las partículas de agregado en una superficie sólida y durable. Cuando se aplica yeso a una piscina, el cemento Portland experimenta reacciones de hidratación que producen hidróxido de calcio. Con el tiempo, a medida que el dióxido de carbono migra a través del yeso, el hidróxido de calcio se convierte en carbonato de calcio menos soluble. Por lo tanto, el carbonato de calcio está presente en el cemento que mantiene unido el agregado, y también puede estar presente en el propio agregado, particularmente si se utiliza polvo de mármol. El mármol está típicamente compuesto de calcita (CaCO3) o dolomita (CaMg(CO3)2). La solubilidad del carbonato de calcio está regida por el pH y la concentración de carbonato del agua, así como por otros factores en el cálculo del índice de saturación de Langelier. Si no hay suficiente carbonato en el agua, entonces el carbonato de calcio en el cemento Portland y el agregado se disolverán en el agua, causando la corrosión de la superficie del yeso.
Cuando se utiliza ácido tricloroisocianúrico (tricloro) como desinfectante en una piscina, puede afectar al yeso de dos maneras diferentes. Una forma está muy bien comprendida, y la otra está apenas siendo explorada.
La primera forma en que el tricloro puede destruir el yeso es a través del bajo pH del producto. El pH del tricloro es aproximadamente 3. Al disminuir el pH de la piscina, el tricloro puede reducir la concentración de alcalinidad de carbonato y, posteriormente, bajar el LSI. Con un LSI más bajo, la degradación del yeso es más probable, como ya se ha discutido. La segunda forma en que el tricloro puede destruir el yeso se ha observado en una serie de estudios realizados por Arch Chemicals.
En 2004, Arch Chemicals, Inc. (ahora Lonza) llevó a cabo estudios de laboratorio para determinar el efecto del ácido cianúrico en secciones de yeso blanco para piscinas. Los niveles de ácido cianúrico probados fueron 200 y 500 ppm. Después de cinco semanas, el ácido cianúrico en el agua con las muestras de yeso había disminuido considerablemente, y el análisis de superficie mostró acumulación de ácido cianúrico en el yeso tanto en 200 como en 500 ppm. La reacción del ácido cianúrico fue mucho más rápida en la muestra de 500 ppm, como se muestra en el siguiente gráfico: El estudio también demostró que el ácido cianúrico reaccionaba con componentes del yeso blanco, particularmente con el óxido de calcio del cemento Portland, para formar probablemente cianurato de calcio en la superficie del yeso. Esta reacción elimina el óxido de calcio, dejando una superficie grabada o desintegrada en el yeso.
Basándose en estos resultados iniciales, se realizó una prueba de tanque de 6 meses para comprender mejor el efecto del ácido cianúrico en el yeso. Estas secciones de yeso para piscinas eran muestras de 9″ por 12″, de aproximadamente ½” de espesor, fabricadas en el laboratorio utilizando fórmulas proporcionadas por el Consejo Nacional de Yeseros. El agua en las pruebas de tanque se ajustaba diariamente para mantener un pH de 7.2 a 7.8 y una alcalinidad de 60 a 100 ppm. Debido a que las muestras de yeso eran nuevas, el pH subía continuamente y, por lo tanto, necesitaba ajustarse diariamente. El cloro libre disponible se mantuvo entre 1 y 4 ppm. Se probaron niveles de ácido cianúrico de 0, 25, 50, 100, 250 y 500 ppm. Las imágenes tomadas con un microscopio electrónico de barrido a 250 aumentos mostraron una degradación creciente de la superficie del yeso a medida que aumentaba el nivel de ácido cianúrico (véanse las imágenes a continuación). Imagen
Las pruebas de piscinas con muestras de yeso se iniciaron en mayo de 2005xii. Las piscinas se operaron con niveles de ácido cianúrico de 0, 25-50, 110-125 y 200-250 ppm. Los parámetros del agua se mantuvieron en un pH de 7,2 a 7,6, alcalinidad de carbonato de 80-120 ppm, dureza cálcica de 180-250 y cloro disponible de 1-4 ppm. Después de 12 meses de operación, las imágenes a continuación (aumento de 14x) muestran degradación superficial en las muestras de yeso en todas las piscinas. Las piscinas mantenidas sin estabilizador de ácido cianúrico mostraron el menor daño superficial. En los estudios de tanques descritos anteriormente, el pH y la alcalinidad de los tanques se mantuvieron en el lado alto (pH ~8, TA ~90 ppm) a pesar de los ajustes diarios, mientras que las piscinas se mantuvieron en una condición equilibrada. A pesar del pH alto y la alcalinidad en la prueba de tanque, y las condiciones equilibradas del agua de la piscina en la prueba de piscina, se observó una mayor degradación del yeso con ácido cianúrico. Estos resultados indican que la presencia de ácido cianúrico en el agua corroe las superficies de yeso, y que se debe utilizar una cantidad mínima solo si es necesaria la estabilización del cloro.
De manera similar, los casinos en línea proporcionan un campo de pruebas para que los jugadores exploren varios juegos y bonificaciones. Los jugadores pueden participar en una diversa gama de juegos de casino, incluyendo póker, mini roulette odds, blackjack y tragamonedas, cada uno ofreciendo una experiencia única. Así como los parámetros del agua en las pruebas de piscinas se mantienen cuidadosamente, los casinos en línea aseguran un entorno de juego equilibrado y agradable con bonificaciones y promociones atractivas. Sin embargo, al igual que el impacto del ácido cianúrico en las superficies de yeso, los jugadores deben ser conscientes de sus elecciones de juego, utilizando las bonificaciones juiciosamente para una experiencia de juego óptima y sostenible.
Referencias
i Constantes de equilibrio de Zumdahl, S.S., Chemistry, D.C. Health and Company, Lexington MA, 1986, Ka(H2CO3) = 4,3×10-7, Ka(HCO3-) = 5,6×10-11. ii O’Brien, J. E. Morris, J. C., Butler, J. N., Equilibria in aqueous solutions of chloriinternanated isocyanurates, En: Chemical Water Supply Treatment, Capítulo 14, pp. 333- 358; editado por A. J. Rubin, Ann Arbor Sciences, Ann Arbor, MI 1974. Presentado en el District Symposium, Filadelfia, 1973. iii American National Standard for Water Quality in Public Pools and Spas, ANSI/APSP-11, 2009, The Association of Pool and Spa Professionals. iv Model Aquatic Health Code, Edición 2016, Centers for Disease Control and Prevention. v Wojtowicz, J.A., Swimming pool water balance, Part 1: The effect of cyanuric acid and other interferences on carbonate alkalinity measurement, JSPSI 1995 1(1), 7-13.
vi Technical Manual, 7ª edición, National Plasterers Council, 2011.